 |
 |
| Figure 1 : Doublets de quelques jours en pâturage à la ferme expérimentale | Figure 2 : Triplets quelques instants après la mise bas en station. |
| Livestock Research for Rural Development 23 (4) 2011 | Notes to Authors | LRRD Newsletter | Citation of this paper |
Le profil de la progestérone (P4) plasmatique au cours de la gestation et l’effet de quelques paramètres de reproduction ont été étudiés en station sur un lot de 23 chèvres naines de la zone forestière du Cameroun. Chez cette race la courbe de la P4 pendant la gestation avait une allure classique et présentait trois phases distinctes : une phase ascendante les soixante premiers jours, suivie d’un plateau jusqu'au 130e jour, puis d’une chute jusqu’à la mise bas vers le 145e jour. Les concentrations moyennes de P4 pendant la phase de plateau étaient comprises entre 8,7 ± 2,7 ng/ml au 60e jour et 9,1 ± 0,8 ng/ml au 130e jour de gestation. Le sexe des petits, la parité de la chèvre et la saison de mise bas n’ont pas influencé de façon significative le niveau de P4 plasmatique à quelque stade que ce soit. Une influence du nombre de fœtus (taille de portée) sur les concentrations de P4 n’a été observée que pendant les 30 premiers jours de gestation (p<0,05). La différence était nette entre les portées simples et les portées doubles, moins avec les portées triples. Quel que soit le stade de gestation, la présence de concentrations de P4 supérieures à 13 ng/ml était associée avec des mises bas de 2 ou 3 petits. Deux groupes de femelles ayant 2 foetus ont été distingués : celles à fortes concentrations de P4 (13,4 ± 3,6 ng/ml au 100e jour) et celles à concentrations faibles (7,7 ± 1,6 ng/ml au 100e jour), suggérant l’existence de populations différentes au sein de la race de chèvres naines. Il a été conclu que la concentration plasmatique de P4 à elle seule ne permettait pas une prédiction précoce rigoureuse du type de naissance attendu chez des femelles en gestation, mais des concentrations très élevées étaient prédictives d’une portée multiple.
Mots-clés: hormone, prédiction, portée, race locale, reproduction
A study on the progesterone profile (P4) in plasma during pregnancy and the effect of some reproductive parameters was carried out on station at Yaounde using 23 local dwarf goats of the forest zone of Cameroon. During pregnancy the curve of P4 in this local breed had a classical shape with three phases: an increasing phase during the first 60 to 70 days, then a plateau till the 130th day followed by a fall before parturition that occurred around the 145th day. The average P4 concentrations in the plateau ranged from 8.7 ± 2.7 ng/ml on day 60th to 9.1 ± 0.8 ng/ml on day 130th of gestation. The sex of the kids, the parity of the doe and the kidding season did not affect the plasma concentration of P4. The number of foetuses (litter size) appeared to affect P4 concentrations during the first 30 days of gestation (P<0.05). This influence was more effective for single birth and twins, and less with triplets. For females with P4 concentrations beyond 13 ng/ml between the 20th and the 140th day of pregnancy, 2 or 3 foetuses were obtained. Two groups of females with 2 foetuses were distinguished: those with high P4 concentrations (13.4 ± 3.6 ng/ml on 100th day) and those with low values (7.7 ± 1.6 ng/ml on 100th day), suggesting the existence of different populations within the dwarf goats. It was concluded that P4 concentrations alone could not permit an early and accurate prediction of the litter size, but high concentrations could help predict multiple births.
Key-words: hormone, litter size, local breed, prediction, reproduction
La maîtrise de la reproduction des petits ruminants est nécessaire pour le développement de leur production, en vue d’une alternative ou d’une solution pour réduire le déficit de l’offre en viande dans les états de l’Afrique Centrale (Djoko et al 2006). Avec plus de 3 millions de têtes de chèvres, le Cameroun constitue un bassin de ressources zoogénétiques de première importance dans cette sous-région Africaine. Parmi les races locales de chèvres connues au Cameroun, on note la chèvre naine de la zone de forêt encore appelée chèvre naine de l’Afrique Centrale (CNAC). Cette race est du même groupe génétique que la Djallonké (chèvre naine d’Afrique de l’Ouest). La chèvre naine, Capra hicus, animal rustique, vit préférentiellement en dessous du 6e parallèle Nord du pays. Elle s’est révélée être d’une grande importance sociale et économique au Cameroun et sa demande nationale voire sous-régionale est sans cesse croissante. A l’instar des autres petits ruminants, sa production est assurée principalement par les petits éleveurs des zones rurales qui pratiquent des systèmes traditionnels peu compétitifs.
Par ailleurs, au cours de la dernière décennie, du fait de la grande urbanisation du pays (plus de 51 % de la population camerounaise est citadine), l’élevage urbain et péri-urbain s’est développé, pour répondre à la forte demande en viande dans les villes. Il se pose avec plus d’acuité le problème de l’introduction de technologies innovantes et la pratique de techniques nouvelles plus adaptées et compétitives pour le développement de l’élevage. Tel est le cas des techniques mises au point pour la maîtrise de la reproduction chez les espèces telles les petits ruminants (Chemineau et al 1999 ; Paterson et al 2003 ; Guignot 2005 ; Meyer et Djoko 2010).
La physiologie reproductive de la chèvre naine de la zone de forêt humide au Cameroun et dans la sous-région Afrique Centrale a jusqu’alors fait l’objet de très peu de travaux malgré ses atouts certains. Des études antérieures ont en effet montré que cette race est très prolifique. Manjeli et al (1994) ont trouvé sur 353 chèvres au terme d’une enquête que 88 % des naissances sont multiples. Parmi ces 88 %, 61 % étaient doubles, 25,7 % triples et 1,3 % quadruples. Malgré ces atouts, on note aussi une forte mortalité (jusqu’à 30 %), surtout chez les jeunes de moins d’un an provenant de portées multiples. L’une des causes principales de cette forte mortalité est l’absence de soins appropriés en phase de reproduction : gestation, mise bas, allaitement.
Peut-on prédire la prolificité avant la mise bas? Un moyen serait l’étude de la progestérone (P4) pendant la gestation. En effet, Jarrel et Dziuk (1991) ont constaté que les valeurs moyennes des concentrations plasmatiques de P4 augmentent avec le nombre de fœtus et surtout avec le nombre de corps jaunes chez les caprins au début de la gestation, particulièrement le 13e jour. Le présent travail se propose d’explorer quelques aspects de l’endocrinologie de la gestation chez la CNAC.
Les objectifs spécifiques de cette étude sont de : 1) caractériser le profil plasmatique de P4 au cours de la gestation chez la CNAC, 2) vérifier s’il existe des relations entre le niveau de P4 plasmatique et le nombre de fœtus, 3) rechercher l’effet de la portée (parité, sexe des petits) et de la saison de mise bas sur les niveaux de P4 plasmatique. Il s’agissait enfin de rechercher s’il existe des différences avec l’endocrinologie pendant la gestation de la brebis, à laquelle la chèvre est souvent comparée ou assimilée du fait de connaissances limitées. Au point de vue pratique, ces informations pourraient permettre d’ajuster l’alimentation et d’augmenter les soins en fonction de la prolificité et ainsi contribuer à la diminution de la mortalité post-partum. Il s’en suivrait une amélioration de la productivité chez la race et l’augmentation des ressources des petits éleveurs.
L’étude a été menée en station, dans la ferme expérimentale du Centre Régional IRAD de Nkolbisson à Yaoundé, dans la zone forestière du Cameroun. Cette zone est comprise entre 2° et 6° de latitude Nord et 10° à 16° de longitude Est. Elle couvre en grande partie le plateau sud-camerounais dont l’altitude varie de 500 à 1000 m, avec des températures moyennes de 25 °C, et une pluviométrie annuelle de 1000-2000 mm. L’ensemble de la zone forestière constitue la zone agroécologique à pluviométrie bimodale, dont le climat de type « guinéen » est caractérisé par quatre saisons de 3 mois chacune, dont les périodes sont grossièrement les suivantes :
Grande saison sèche (GSS) : décembre à février,
Petite saison des pluies (PSP) : mars à mai,
Petite saison sèche (PSS) : juin à août,
Grande saison des pluies (GSP) : septembre à novembre.
L’étude a duré 26 mois, de mars 2008 à mai 2010, et couvert 3 petites saisons des pluies, 2 petites saisons sèches, 2 grandes saisons des pluies et 2 grandes saisons sèches. Les mises bas dans notre étude ont été enregistrées au cours de 3 saisons à savoir : GSS, PSP et PSS.
Sur un troupeau expériemental de départ de 30 chèvres mises en reproduction avec deux boucs adultes en monte naturelle libre, seules les chèvres dont les gestations sont arrivées à leur terme ont été considérées pour l’étude, soient 23 chèvres, les autres étant écartées pour insuffisance de données. Chez ces 23 chèvres, un total de 24 gestations normales ont été enregistrées, dont deux gestations successives enregistrées chez une des chèvres. Mâles et femelles étaient laissés ensemble au pâturage comme dans la bergerie. Les animaux étaient tous des caprins de la race naine de la zone de forêt du Cameroun. Leurs âges étaient compris entre 2 et 5 ans. Le poids moyen des femelles était de 17,7 ± 3,5 kg au début de l’essai (de 15 kg à 27,2 kg). Les femelles de l’étude ont été retenues après confirmation de leur état physiologique (gestation) par des dosages de P4 plasmatique.
Les chèvres étaient nourries principalement à l’herbe de pâturage (Stylosanthes gracilis, Brachiaria guyanensis, Trypsacum laxum, Setaria sp.). En saison sèche, du foin et de l’herbe du Guatemala (Tripsacum laxum) étaient fournis ad libitum dans les râteliers. Un complément alimentaire de concentré d’environ 200 g par tête (Tableau 1) ou de grains (maïs) était fourni chaque jour au troupeau avant la mise en pâturage. L’eau était disponible à volonté. Enfin des blocs de pierre à lécher (complément minéral) étaient mis à la disposition des chèvres.
|
Tableau 1. Composition de la ration de complémentation |
|
|
Ingrédients |
Quantité (kg) |
|
Maïs Tourteau de coton Son de blé/riz Farine d’os Urée Sel de cuisine Prémix* |
30 30 25 12 2 1 + |
|
: + ajout de 25 g à chaque100 kg d'aliment préparé (0,25 %). *Prémix = mélange de plantes naturelles, de cendres de bois, de farine de poisson (ou d'asticots), de Piment rouge. Le prémix est très riche en protéines et en vitamines, il s'incorpore à environ 0,2-0,5 %. |
|
La vaccination contre la peste des petits ruminants (multicaprivax) a été effectuée avant le début de l’essai et une fois par an au cours de l’essai. Le suivi sanitaire général des animaux était régulier (déparasitage trimestriel à l’Ivermectine/Levamisole) et les traitements nécessaires administrés selon les besoins. Les mises bas ont eu lieu dans la bergerie, généralement dans la nuit. Une pesée mensuelle des chèvres était effectuée. Les poids retenus étaient ceux obtenus aux environs de la période de fécondation jusqu’à un mois après la mise bas.
L’état corporel des animaux était suivi individuellement. La note d’état corporel générale du troupeau expérimental a été régulièrement déterminée suivant la méthode de Hervieux et Morand-Fehr de l’INRA (1999).
Les cas d’avortement, les mises bas, les poids des petits à la naissance, le type de naissance (Figures 1 et 2), le sexe des petits, la période (saison) de mise bas et la parité de la mère ont été enregistrés.
 |
 |
| Figure 1 : Doublets de quelques jours en pâturage à la ferme expérimentale | Figure 2 : Triplets quelques instants après la mise bas en station. |
Le moment de la fécondation pour le cas des mises bas normales a été estimé par déduction à partir de la date de mise bas. La durée moyenne de gestation a été estimée à 145 jours, comme trouvé par Akusu et Ajala (2000) chez la chèvre de même groupe génétique au Nigeria voisin.
Du sang jugulaire (4 ml) a été prélevé sur chacune des chèvres tous les 6 à 10 jours depuis le moment de la fécondation jusqu’après la mise bas. Le sang recueilli a été centrifugé dans les 30 minutes suivant la collecte (3000 tours/min pendant 15 min). Le plasma sanguin a été séparé puis conservé au congélateur à – 15°C jusqu’au moment du dosage.
La P4 a été dosée par une méthode immuno-enzymatique de type ELISA (Canépa et al 2008). Selon cette méthode et à l’instar des méthodes d’immuno-dosages dites par compétition, la P4 à doser est mise en compétition avec une P4 conjuguée à un marqueur pour se lier à un anticorps anti-P4.
Les dosages ont été réalisés sur 10 ml de plasma. L’anticorps utilisé était un anticorps monoclonal de souris obtenu par immunisation avec un conjugué P4-11a-hémisuccinate-BSA (Biogenesis, Abcys, SA). Cet anticorps présentait un taux de croisement de 40 % avec le 5a-pregnan-3, 20-dione, et seulement de 1,6 % avec la 17-hydroxyP4, 0,2 % avec la prégnénolone, 0,3 % avec la corticostérone, 0,55 % avec l’androstènedione et moins de 0,1 % avec les autres stéroïdes. Le traceur de nature colorimétrique était du pNPP (p-nitrophénylphosphate, Sigma). La lecture a été effectuée à 405 nm (Spectracount, Perkin Elmer). L’étendue de la gamme utilisée, la sensibilité du dosage (4 pg/tube), son exactitude et sa précision (coefficient de variation intra-dosage inférieur à 10 %) ont été validées par Canépa et al (2008).
Pour des raisons pratiques, la durée de la gestation a été subdivisée en phases de 10 jours chacune, de la fécondation jusqu’à la mise bas aux environs du 145ème jour. Pour chaque chèvre en gestation, les niveaux de P4 tous les 10 jours ont été calculés quand nécessaire à partir des 2 valeurs de concentration de P4 qui encadraient les dates considérées.
Outre les statistiques descriptives (graphique et données numériques), une ANOVA (analyse de variance) a été faite individuellement pour prendre en compte l’effet de différentes variables (poids de la femelle, parité, saison de mise bas, sexe) sur la P4 plasmatique à l’aide de la Procédure GLM (modèle linéaire généralisé) du logiciel SAS version 8 (SAS 1999). Le modèle mathématique retenu était le suivant :
P4ijklm = μ + Si + Sxj + Pk + Wl + εijklm
Avec P4ijklm : valeur de la P4 dosée au cours de la gestation dans le troupeau expérimental ; μ : moyenne générale de la P4 au cours de la gestation ; Si : effet de la saison de mise bas i sur la P4 de la chèvre (avec i = 1, 2, 3 et 4) ; Sxj : effet du sexe j du nouveau-né (avec j = 1,2,3) ; Pk : effet de la parité k de la chèvre (avec k = 1, 2, 3, 4 ) ; Wl : poids de la chèvre l au cours de la gestation (avec l = 1, 2, 3, …, 24); εijklm : effet résiduel propre à la chèvre supposé uniformément réparti, avec pour moyenne zéro et variance s².
Par ailleurs, pour mieux rendre compte des observations enregistrées sur les concentrations plasmatiques de P4 dans le groupe des femelles à portée double, une analyse multivariée en composantes principales et une classification ascendante hiérarchique ont été réalisées. Les niveaux de la P4 dans ledit groupe à différentes décades de la gestation ont ainsi été analysés.
 |
| Figure 3. Suivi pondéral des chèvres par type de portée au cours de la gestation |
Chez les femelles avec portées simples (n = 7) la moyenne générale de l’évolution pondérale (Figure 3) a varié de 15 ± 0,8 kg vers la fécondation à 21 ± 3,1 kg à la parturition, les minimum et maximum étant de 13,4 kg et 24,9 kg respectivement. Chez les femelles avec portées doubles (n = 13), ces valeurs ont été de 18,7 ± 3,8 kg et 26,4 ± 4,6 kg d’une part, 15,1 kg et 34,5 kg d’autre part, respectivement ; et pour les femelles avec portées triples (n = 4) de 18,7 ± 4,2 kg et 28,5 ± 7,9 kg d’une part, 15 kg et 35,5 kg d’autre part, respectivement.
Les femelles sont d’autant plus lourdes (Figure 3) que leur portée est grande (p < 0,05). Ainsi, les femelles de portée triple sont plus lourdes que celles de portée double (p < 0,05), lesquelles sont plus lourdes que celles de portée simple (p < 0,05). La perte de poids observée à la mise bas ou juste après est plus importante chez les femelles à portées triples que celles avec portées doubles.
Enfin, les femelles de portée simple sont de manière générale plus légères (P<0,05) que celles à portée multiple pendant la période de reproduction (au moment de la fécondation : 15 ± 0,8 kg contre 18,7 ± 3,8 kg), on ne note par contre aucune différence significative de poids (p>0,05) entre les femelles à portée double et triple en période de reproduction.
Elle a varié de 3,25 ± 0,5 en début d’essai à 4 ± 0,5 en fin d’essai en moyenne, les notes les plus élevées étant relevées chez les femelles qui plus tard ont donné des portées multiples.
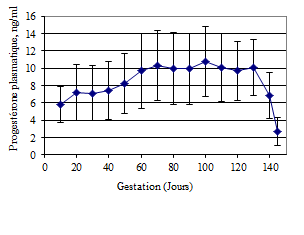
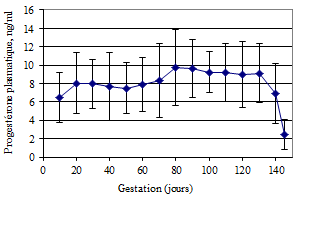
La courbe moyenne de P4 pendant la gestation de l’ensemble des chèvres étudiées (Figures 4, 5, 6, 7) est classique. Elle présente une phase ascendante pendant les 60-70 premiers jours avec des valeurs moyennes variant de 5,4 ± 0,3 à 8,7 ± 2,7 ng/ml, suivie d’un plateau jusqu’au 130ème jour de gestation, avec des valeurs moyennes de P4 fluctuant entre 8,7 ± 2,7 et 9,1 ± 0,8 ng/ml. Au cours des 60-70 premiers jours, les concentrations de P4 sont croissantes de la fécondation jusqu’au jour 20, restent assez constantes jusqu’au jour 40 avant de remonter progressivement jusqu’au 60e jour, les valeurs maximales sont obtenues vers le 70e jour ou légèrement au-delà. Une chute des concentrations est observée au-delà du jour 130. Elle s’accentue du 140e jour jusqu’à la mise bas vers le 145e jour.
 |
 |
| Figure 4 : Concentration moyenne de P4 dans le plasma pendant la gestation (n = 24). |
Figure 5 : Concentration moyenne de P4 dans le plasma chez les femelles à portées simples (n = 7). |
 |
 |
| Figure 6 : Concentration moyenne de la P4 dans le plasma chez les femelles à portées doubles n = 1 (3). | Figure 7 : Concentration moyenne de P4 dans le plasma chez les femelles à portées triples (n = 4). |
Les mises bas ont eu lieu presque toutes pendant la saison 1 (grande saison sèche) et la saison 2 (petite saison des pluies). Aucune influence de la saison de mise bas n’a été observée sur les concentrations plasmatiques de P4 au cours de la gestation (p>0,05).
 |
|
Figure 8 : Concentration moyenne de P4 dans le plasma pendant la gestation selon la saison de mise bas. |
Les différences entre les concentrations de P4 au cours de la gestation (entre 80 et 140 jours de gestation) pour les mises bas dans les deux saisons (Figure 8) ne sont pas significatives (p>0,05) (la saison 3 - petite saison sèche - n’a pas été considérée du fait d’une seule donnée disponible).
Au cours du premier mois de gestation (30 premiers jours), on a noté une tendance générale d’augmentation des concentrations de P4 en fonction de la portée (nombre de fœtus), les portées triples présentant des valeurs moyennes supérieures à celles des portées doubles, elles mêmes supérieures à celles des portées simples (p< 0,05) (Figure 9). A partir du 30è jour on note globalement une stabilisation du niveau de P4 plasmatique jusqu’au 40è-50è jour chez les portées multiples, alors que chez les portées il s’observe une baisse du niveau de P4 jusqu’au 40è jour, puis une augmentation. Dans tous les trois groupes de chèvres le niveau de P4 plasmatique est croissant entre 50 et 60 jours de gestation. Au-delà de 60 jours de gestation, aucune influence nette de la portée sur le niveau de la P4 plasmatique n’a été relevée (p>0,05).
 |
|
Figure 9 : Concentration moyenne de la P4 plasmatique pendant la gestation (chèvres avec fœtus simples, doubles ou triples) |
Sur les 24 mises bas, 7 étaient simples avec un seul jeune à la naissance, 13 étaient doubles, et 4 étaient triples. Lorsque l’une des valeurs ponctuelles de concentration de P4 était supérieure à 13 ng/ml au cours de la gestation, il a toujours été observé qu’à la mise bas la chèvre donnait naissance à 2 ou 3 petits, jamais 1 seul. Mais des valeurs de P4 inférieures à 13 ng/ml pendant la gestation n’étaient par contre pas discriminantes puisque dans ce cas la chèvre pouvait indifféremment donner naissance à 1, 2 ou 3 petits.
Une grande variabilité inter individuelle du niveau de P4 plasmatique s’est observée chez les femelles ayant 2 fœtus, avec des concentrations assez faibles de P4 chez certaines. Au terme d’une analyse en composantes principales avec une classification ascendante hiérarchique par rapport aux concentrations de P4, il a été possible de mettre en évidence l’existence de deux classes distinctes: celles présentant des concentrations faibles (4 à 9 ng/ml entre 20 et 130 jours de gestation, n = 6) et celles qui présentant des concentrations fortes (9 à 14 ng/ml entre 20 et 130 jours de gestation, n = 7) (Figures 10, 11, 12).
 |
 |
| Figure 10 : Arbre hiérarchique de classification des femelles à portées doubles (n=13). | Figure 11 : Répartition graphique des femelles avec faibles concentrations et fortes concentrations de P4, respectivement (les numéros identifient les chèvres) |
 |
 |
|
Figure 12 : Concentrations moyennes de P4 dans le plasma de 2 classes de chèvres avec portées doubles. Les deux classes sont constituées de femelles dont les concentrations de P4 sont soit supérieures (n=6), soit inférieures (n=7) à la moyenne générale dans le groupe pendant la gestation. |
Figure 13 : Concentrations moyennes de P4 dans le plasma de chèvres à portées simples et de chèvres à portées doubles appartenant à la classe des animaux à faibles concentrations de P4. |
Enfin, aucune différence significative (P>0,05) n’a été notée entre les concentrations de P4 pendant la gestation chez les femelles à portée simple et celles des femelles à portées doubles appartenant à la classe des animaux à faibles concentrations de P4 (Figure 13).
Les valeurs moyennes de concentrations plasmatiques de P4 à 60 jours de gestation étaient de 6,0 ± 1,4 ng/ml chez les femelles à portée simple porteuses d’un fœtus mâle et de 8,7 ± 3,7 ng/ml chez celles porteuses d’un fœtus femelle. Ces valeurs à 120 jours de gestation étaient de 7,7 ± 2,8 ng/ml pour les mâles et 8,6 ± 3,0 ng/ml pour les femelles. Malgré une tendance à des concentrations de P4 plus élevées chez les chèvres porteuses de fœtus femelles par rapport aux chèvres porteuses de fœtus mâles, aucune différence statistiquement significative (p>0,05) n’a été notée entre les deux types de porteuses.
Dans notre étude, la parité n’a pas eu d’influence statistiquement significative sur les concentrations plasmatiques de P4 pendant la gestation chez la chèvre naine (p > 0,05). Il a été noté une plus grande fréquence de portées multiples chez les multipares. Ainsi, sur 7 mises bas simples, 4 l’ont été des primipares, 2 de femelles ayant mis bas une première fois et 1 seule d’une femelle ayant mis bas 2 fois. De même sur 13 mises bas doubles, seules 4 l’ont été de femelles primipares et 6 de femelles ayant mis bas une première fois. Enfin, 1 mise bas triple sur 4 l’a été d’une femelle primipare.
L’état physique de la chèvre, à l’instar des autres espèces animales, est l’un des premiers paramètres à contrôler pour une bonne réussite de l’activité reproductrice, ceci à tous les stades de son évolution : oestrus, fécondation, gestation, mise bas. Il s’apprécie à l’apparence physique et au poids.
Lors d’une étude antérieure sur la synchronisation naturelle de l’oestrus par l’effet mâle chez la chèvre naine, Djoko et al (2006) avaient déjà noté que l’activité oestrienne (survenue des chaleurs) dans cette race locale n’était guère observée chez des femelles ayant un poids corporel inférieur à 12 kg, quelque soit l’âge. Au cours de la présente étude, le poids moyen proche de la période de fécondation (15 ± 0,8 kg, avec le minimum à 13,4 kg) était bien supérieur à ce poids « seuil » de 12 kg, en effet aucune gestation n’a été enregistrée dans le troupeau de départ en deçà de ce seuil. On pourrait dès lors penser qu’il existe effectivement un poids seuil chez la chevrette/chèvre en deçà duquel la gestation ne peut se dérouler normalement. En effet, Mbayahaca et al (1997), Thimonier (1975) ont montré que la fertilité augmentait avec le poids des femelles chez les caprins. Ce poids seuil correspondrait à environ 55 % du poids adulte dans la présente étude. Il pourrait dès lors être conseillé aux éleveurs de ne mettre les femelles en reproduction qu’à partir de 13 kg de poids vif pour une bonne croissance de la jeune chèvre et un bon développement du fœtus. Toutefois, une alimentation adéquate devrait être fournie aux jeunes femelles ainsi mises en reproduction.
Le gain de poids des chèvres était constant au cours des deux premiers mois de gestation. Il coïncidait avec la première phase de la courbe de production de la progestérone pendant la gestation qui va de la fécondation au 60ème voire 70ème jour, où les valeurs maximales sont atteintes. Le poids augmentait ensuite considérablement au-delà du deuxième mois jusqu’à une valeur maximum au quatrième mois. Ces deux phases correspondent à la mise en place des organes du fœtus et à leur développement. En effet, la maturation du fœtus une fois son développement achevé se traduit par une prise pondérale importante qui culmine au 4ème mois et reste plus ou moins constante jusqu’au au 5ème mois de gestation. La croissance pondérale est un indicateur de l’intégrité de la gestation, donc du bon déroulement des processus physiologiques liés à la gestation. Au cours de la présente étude, la différence significative observée entre les poids des femelles à portée simple et les autres au moment de la fécondation et pendant la gestation jusqu’à la mise bas suggère que l’état corporel influence le nombre d’ovulations, et donc le nombre de fœtus après fécondation. En accord avec cette hypothèse, un effet de l’état corporel sur le nombre d’ovulations a été rapporté chez des chèvres soumises à des niveaux d’alimentation différents (Henniawati et Fletcher 1986 ; De Santiago-Miramontes et al 2009).
En référence aux poids à la naissance (1,1 kg à 1,6 kg) et à la puberté récemment déterminés chez la chèvre naine (Djoko et al soumis pour publication), l’évolution pondérale des femelles au cours des deux premiers mois gestation dans notre étude pourrait être utilisé comme un indicateur pratique de détermination précoce du type de gestation. En effet, pour tout gain de poids vif supérieur ou égale à 1,5 kg sur une période de 30 jours consécutifs au cours des 2 premiers mois (60 jours) de gestation, une mise bas multiple a été obtenue. Ce gain pondéral entre 30 à 60 premiers jours de gestation indiquerait donc la présence de plusieurs fœtus. Il peut dès lors être recommandé aux éleveurs pour les cas avérés l’apport d’un supplément alimentaire dès ce stade jusqu’au 4ème mois de gestation, afin de garantir une bonne croissance des fœtus.
La courbe de progestérone décrite pendant la gestation chez la chèvre naine de la zone de forêt du Cameroun présente globalement les caractéristiques classiques décrites chez les caprins (Catchpole 1977). Les valeurs maximales de progestérone ont été obtenues vers le 70ème jour de gestation ou légèrement au delà, soit globalement à mi-parcours de la gestation qui dure environ 145 jours comme observé chez les caprins par Catchpole (1977). Les valeurs observées dans notre étude sont similaires à celles rapportées par Khanum et al (2007 et 2008) chez la chèvre naine du Pakistan (Capra hircus) en période de reproduction (oestrus) et pendant la gestation.
L’augmentation irrégulière du niveau de progestérone observée pendant la gestation chez la chèvre pourrait être liée à l’augmentation de taille des cellules lutéales stéroïdogéniques qui a été constatée pendant la gestation chez la chèvre (Robertson 1977 ; Yigit 2003). En effet, il a été noté chez les caprins qu’après une augmentation initiale au cours des 40 premiers jours de la gestation, la taille des cellules lutéales se réduit, puis augmente jusqu’au 110ème jour de gestation, avant une légère diminution jusqu’à la parturition. La courbe générale d’évolution de la progestérone au cours de la gestation dans notre étude (Figure 3) présente un profil très similaire.
Par ailleurs, chez la chèvre le placenta produit des métabolites de la progestérone tels que la 20a-dihydroprogestérone et le 5b-prégnanediol (Sheldrick et al 1981 ; Wango et al 1991 ; Sawada et al 1994). Cette sécrétion de progestagènes placentaires pourrait expliquer le décrochement de la courbe observé entre les 40e et 70e jours de gestation. Néanmoins, il faudrait étudier le croisement de ces composés dans le dosage de progestérone utilisé pour valider cette hypothèse. Chez les ovins, un décrochement se produit vers les 50-60e jours de gestation, en relation avec le développement du placenta qui devient le lieu principal de synthèse de la progestérone en plus des corps jaunes (Emady et al 1974). Mais contrairement à la chèvre où le pic est observé vers la moitié de la gestation, les valeurs maximales de la progestérone sont atteintes vers la fin de la gestation (dernier tiers) chez la brebis (Catchpole 1977).
Notons qu’une infection de la chèvre pendant la gestation, pouvant se traduire par un avortement, perturbe la fonction endocrinienne et diminue le niveau de progestérone (Engeland et al 1997). Tous les cas douteux ou présentant de graves perturbations au cours de la gestation ont été éliminés de notre étude. Par ailleurs, Fasanya et al (1992) ont trouvé au Nigeria un niveau de progestérone plus élevé pendant la gestation dans le groupe des chèvres Savanna Brown les plus lourdes, complémentées au maïs. Nous n’avons pas constaté une influence sensible de l’apport en maïs au cours de notre étude, toutes les chèvres étant soumises au même régime alimentaire avec entre autres des apports fréquents en grains de maïs en substitution au complément alimentaire de base.
Pendant la gestation chez les mammifères, la progestérone peut être secrétée par le(s) corps jaune(s) ovarien(s), par le placenta et/ou par les glandes surrénales. Chez les petits ruminants, les glandes surrénales en sécrètent très peu : environ 2 % ou moins de la production ovarienne (Linzell et Heap 1968 ; Kolb 1975). Chez la brebis, l’ovaire et le placenta produisent de la progestérone, et le niveau de progestérone pendant la gestation est en relation avec la masse du placenta (Butler et al 1981). Il augmente avec la taille du fœtus et de ses annexes (Boly et al 1993). Ainsi, Benyounes et al (2006) ont observé une variation significative du niveau de progestérone pendant la gestation en fonction du stade de gestation et non pas en fonction du nombre de fœtus chez la brebis Ouled Djellal en Algérie (Ozpnar et al 1992 ; El Amiri et al 2003). Chez la chèvre, le placenta ne produit pas ou très peu de progestérone et, à la différence de la brebis, une ovariectomie pratiquée en 2e moitié de gestation entraîne toujours l’avortement. La brebis est donc une espèce dépendant du placenta pour la gestation et la chèvre est une espèce dépendant des corps jaunes (Linzell et Heap 1968 ; Thorburn et Schneider 1972 ; Kolb 1975 ; Catchpole 1977 ; Robertson 1977 ; Hafez 1987).
Beaucoup d’auteurs ont déjà signalé que le niveau de progestérone à certains moments pendant la gestation était en relation avec le nombre de fœtus chez les caprins (Jarrel et Dziuk 1991 ; Abou-el-Roos et Abdel-Ghaffar 2000) et surtout chez les ovins (Emady et al 1974 ; Butler et al 1981 ; Rawlings et al 1983 ; Dobeli et Schwander 1983 ; Ozpnar et al 1992 ; Ranilla et al 1997). Abou-El-Roos et Abdel-Ghaffar (2000) signalent même une augmentation significative chez les chèvres avec triplets par rapport aux chèvres avec fœtus doubles. Dans notre étude, une influence significative de la portée a été observée pendant le premier mois de gestation, le niveau de progestérone étant d’autant plus grand que la taille de la portée était large. Ainsi, au 30ème jour de gestation il existe une différence significative entre les niveaux de progestérone chez les femelles portant trois fœtus et celles n’en ayant que deux ou un. Cette influence n’était plus nette au-delà de cette période. Ces résultats sont en accord avec les travaux de Jarrel et Dziuk (1991) dans l’Illinois. Ces auteurs ont montré que les chèvres ayant plusieurs corps jaunes ont entre le 7ème et le 30ème jour de gestation une concentration de progestérone plus élevée que celles n’en ayant qu’un seul. De plus, d’après ces auteurs, les chèvres portant deux fœtus à 45 jours de gestation ont au 13ème jour de gestation une plus forte concentration plasmatique de progestérone que celles ne portant qu’un seul fœtus. Néanmoins, le nombre de corps jaunes ou de fœtus n’influence pas la concentration plasmatique de progestérone au-delà du 30ème jour de gestation. On pourrait donc penser que la quantité de P4 produite pendant la gestation dépendrait plus de la fonctionnalité des cellules lutéales que de leur nombre. Notons que les informations sur la relation entre le nombre d’ovulations, le nombre d’embryons en début de gestation ou de foetus, et la portée lors de la mise bas, ne sont pas encore disponibles chez la race étudiée.
Les femelles ayant deux fœtus ont présenté en moyenne des niveaux de progestérone plus élevés que ceux des femelles ne portant qu’un seul fœtus. Par contre, il semble bien y avoir dans notre étude 2 classes distinctes dans le groupe de chèvres à portée double (deux fœtus), certaines avec des niveaux élevés de progestérone pendant la gestation, d’autres avec des niveaux aussi bas que ceux des chèvres à portée simple (un fœtus) ; ceci ne nous semble pas encore avoir été signalé. Ces 2 classes ne peuvent pas être expliquées par le fait que les jumeaux seraient univitellins ou non, les 2 sexes étant souvent présents lors des mises bas. L’existence des deux classes pourrait résulter de l’existence d’une variabilité génétique au sein de la race.
Chez la chèvre, contrairement au mouton, certains auteurs ont signalé que le plus souvent le nombre total de corps jaunes sur les 2 ovaires correspond au nombre de fœtus. Nous ne pouvons pas envisager cette correspondance pour la chèvre naine ici étudiée, du fait de la présomption d’une possible mortalité embryonnaire assez fréquente chez la race. De même nous ne pouvons pas affirmer que la portée est un indicateur fiable du nombre d’embryons en début ou en cours de gestation. Les fluctuations des concentrations de progestérone au cours de la gestation pourraient, comme signalé plus haut, correspondre à des variations de la taille des cellules lutéales (Robertson 1977). Elles pourraient également résulter des réactions métaboliques que subit la progestérone plasmatique au niveau du foie. Elles pourraient enfin résulter d’une dégénérescence d’un certain nombre de corps jaunes gestatifs.
Dans la présente étude il n’a pas été possible de prédire le nombre de fœtus d’après les seuls niveaux de progestérone mesurés pendant la gestation. Ceci s’explique par le fait que chez la chèvre c’est le corps jaune qui est la source principale de la progestérone au cours de la gestation. La masse placentaire a ici un rôle négligeable dans la production de la progestérone. Toutefois, toutes les chèvres ayant présenté des valeurs de progestérone supérieures à 13 ng/ml ont eu une mise bas multiple sans exception. Cette indication pourrait, une fois confirmée, permettre de distinguer dans un lot de femelles en gestation celles porteuses d’un fœtus de celles en portant plusieurs.
La distribution des mises bas au cours de l’année dans les systèmes d’élevage étudiés est tributaire aussi bien de la fertilité des boucs que de l’activité ovarienne chez les femelles. Le regroupement ici de la quasi-totalité des mises bas pendant la saison 1 (grande saison sèche) et la saison 2 (petite saison des pluies) suggère l’existence de périodes plus favorables à la fécondation naturelle chez la race (Djoko et al soumis pour publication). Cette période se situe à environ cinq mois plus tôt par rapport aux saisons de mises bas enregistrées. L’absence d’influence de la saison de mise bas sur les concentrations plasmatiques de progestérone au cours de la gestation s’expliquerait par le fait que la saison n’influence pas l’activité lutéale qui assure le maintien la gestation chez les caprins comme relevé plus haut. En revanche la saison de mise bas, comme l’année de naissance et la parité, aurait un effet significatif (p<0,05) sur la portée (Odubote 1994).
Le sexe du fœtus pourrait avoir une influence sur le niveau de progestérone. En effet, Dobeli et Schwander (1985) ont montré chez le mouton alpin que s’agissant du sexe du fœtus, 2 mâles sont accompagnés d’un niveau de progestérone moins élevé que 2 femelles. De même, ils observent également une différence entre femelle à portée simple et celles à portée double avec au moins un mâle. Par contre, Kalkan et al (1996) n’ont pas trouvé de différence significative selon le sexe des fœtus chez le mouton Iwassi. Au cours de la présente étude les valeurs de la progestérone dans le groupe des chèvres à portées simples portant un fœtus femelle étaient faiblement supérieures à celles obtenues chez les femelles portant un fœtus mâles entre 60 et 120 jours de gestation, mais cette différence n’était toutefois pas significative. Dans le cas des portées multiples (doublets et triplets), le sexe des petits au cours de la gestation n’a pas influencé de façon significative les concentrations de P4 plasmatique.
Relations entre niveau de progestérone et la parité de la chèvre
Aucune influence significative de la parité sur le niveau de progestérone au cours de la gestation n’a été enregistrée au cours de notre étude. Dans un autre travail sur l’effet de la parité sur la réponse oestrienne et ovulatoire des chèvres à l’effet mâle, Luna-Orozco et al (2008) ont trouvé que la parité n’influence pas la réponse endocrinienne des femelles soumises à cette étude. Il a été toutefois noté ici que la taille de la portée augmente avec la parité. Les mises bas simples ont été en effet obtenues en majorité chez les primipares et sont exceptionnelles chez les multipares. Notons qu’il a été montré (Clément et al 1997) que l’âge à la première mise bas a un effet significatif sur la prolificité: les femelles qui mettent bas tardivement ont des tailles de portée plus élevées et l’intervalle entre mises bas diminue lorsque le rang de mise bas augmente. De nombreux résultats allant dans ce sens ont été rapportés : le taux d’ovulation et la prolificité augmentent avec l’âge des femelles (Lajous 1987, Waldron et Thomas 1992). Cette observation est certainement liée à la croissance des femelles, puisque les premières naissances se produisent avant que celles-ci n’aient atteint leur poids adulte et il a été montré que la fertilité augmentait avec le poids des femelles (Thimonier 1975, Mbayahaca et al 1997).
Les résultats de la présente étude ont permis de déterminer les différents profils de progestérone dans le plasma au cours de la gestation chez la chèvre naine de la zone de forêt du Cameroun, et de souligner quelques particularités qui marquent la différence avec l’endocrinologie de la gestation chez les ovins. Les niveaux plasmatiques de progestérone déterminés pour les différents types de gestation rencontrés dans la race ont confirmé les résultats de certains travaux antérieurs sur d’autres races de caprins. Ils ont permis de mettre en évidence l’existence de classes distinctes parmi les femelles à gestations doubles. Un suivi échographique de l’activité ovarienne et des différentes étapes de la gestation apporterait certainement plus d’informations sur cette réalité. Pour une perspective plus pratique, il a été trouvé que chez cette race, une valeur de progestérone plasmatique supérieure à 13 ng/ml entre le 20e et le 140e jour de gestation indique que la femelle porte deux ou trois fœtus. De même, une variation pondérale supérieure ou égale à 1,5 kg sur une période de 30 jours consécutifs au cours des 2 premiers mois de gestation, est un indicateur de gestation multiple ; ce qui implique une supplémentation alimentaire conséquente pour une bonne gestation.
Les auteurs expriment leur profonde gratitude à l’endroit du gouvernement camerounais, des responsables de l’Institut de Recherche Agricole pour le Développement (IRAD) et de l’Institut National de la Recherche Agronomique (INRA-Département PHASE/PRC-Tours Nouzilly). C’est grâce à leur soutien financier et matériel que cette étude a été initiée et menée à son terme.
Abou-El-Roos M E A and Abdel-Ghaffar A E 2000. Monitoring the postpartum ovarian activity and pregnancy in she goats with normal and abnormal parturition by measuring milk and faecal progesterone. Assiut Veterinary Medical Journal 42: 310-327.
Akusu M O and Ajala O O 2000. Reproductive performance of West African Dwarf goats in the humid tropical environment of Ibadan. Israel Journal of Veterinary Medecine 55 (2) http://www.isrvma.org/article/55_2_6.htm: onlinelibrary.wiley.com/doi/10.1111/j.1748-5967.2007.00048.x/full
Benyounes A, Lamrani F, Melo de Sousa N, Sulon J, Folch J, Beckers J-F and Guellati M A 2006. Suivi de la gravidité chez la brebis Ouled Djellal par dosage de la protéine associée à la gestation et de la progestérone. Revue d’Elevage et de Médecine Vétérinaire des Pays Tropicaux (FRA) 59 (1-4): 65-73. http://remvt.cirad.fr/cd/derniers_num/2006/EMVT06_065_073.pdf
Boly H, Koubaye A, Viguier-Martinez M C and Yenikoye A 1993. Gestation et reprise de l'activité sexuelle après le part chez la brebis Djallonké, variété "Mossi". Revue d'Elevage et de Médecine Vétérinaire des Pays Tropicaux (FRA) 46 (4): 631-636. http://remvt.cirad.fr/cd/EMVT93_4.pdf
Butler W R, Fullenkamp S M, Cappiello L A and Handwerger S 1981. The relationship between breed and litter size in sheep and maternal serum concentrations of placental lactogen, estradiol and progesterone. Journal of Animal Science 53 (4): 1077-1081. http://jas.fass.org/cgi/reprint/53/4/1077.pdf
Canépa S, Lainé A-L, Bluteau A, Fagu C, Flon C et Monniaux D 2008. Validation d’une méthode immunoenzymatique pour le dosage de la progestérone dans le plasma des ovins et des bovins. Cahier Technique de l’INRA 64, 19-30.
Catchpole H R 1977. Hormonal Mechainisms in Pregnancy and Parturition. 341-368. In “Reproduction in domestic animals” (Cole H. H. and Cupps P T, eds) 3rd ed. Academic Press, New York, 665 p.
Chemineau P, Baril G, Leboeuf B, Maurel M C, Roy F, Pellicer-Rubio M, Malpaux B et Cognié Y 1999. Implication des progrès récents en physiologie de la reproduction pour la conduite de la reproduction dans l’espèce caprine. INRA Productions Animales 12 (2) 135-146. http://granit.jouy.inra.fr/productions-animales/1999/Prod_Anim_1999_12_2_05.pdf
Clément V, Poivey J P, Faugère 0, Tillard E, Lancelot R, Gueye A, Richard D, Bibé B 1997. Etude de la variabilité des caractères de reproduction chez les petits ruminants en milieu d’élevage traditionnel au Sénégal. Revue d'Elevage et de Médecine Vétérinaire des Pays Tropicaux 50 (3) : 235-249. http://www.sist.sn/gsdl/collect/publi/index/assoc/HASH015a/47d11402.dir/doc.pdf
De Santiago-Miramontes M A, Malpaux B and Delgadillo J A 2009. Body condition is associated with a shorter breeding season and reduced ovulation rate in subtropical goats. Animal Reproduction Science 114: 175–182
Dobeli M and Schwander B 1983. Pregnancy diagnosis in a sheep flock from 3 estimations of plasma progesterone. Kleinviehzuchter 31: 27-28.
Dobeli M and Schwander B 1985. Pregnancy diagnosis in a flock of sheep by means of three blood plasma progesterone assays. Zuchthygiene 20: 192-199.
Djoko T D, Kamtchouing P, Mbah D A et Meyer C 2006. Induction et synchronisation naturelles par l’effet mâle de l’eostrus chez la chèvre naine de la zone de forêt du Cameroun. Cameroon Journal of Agricultural Science (2006) Vol. 2 N°1 pp 31-37.
El Amiri B, Karen A, Cognie Y, Sousa N M, Hornick J L, Szenci O and Beckers J F 2003. Diagnostic et suivi de gestation chez la brebis : réalités et perspectives. INRA Productions Animales 16 (2) : 79-90.
http://granit.jouy.inra.fr/productions-animales/2003/Prod_Anim_2003_16_2_01.pdf
Emady M, Hadley J C, Noakes D C and Arthur G H 1974. Progesterone level in the peripheral blood of pregnant ewes. Veterinary Record 95: 168-169.
Engeland I V, Waldeland H, Ropstad E, Kindahl H and Andresen O 1997. Effect of experimental infection with Listeria monocytogenes on the development of pregnancy and on concentrations of progesterone, oestrone sulphate and 15-ketodihydro-PGF2 alpha in the goat. Animal Reproduction Science 45 (4): 311-327.
Fasanya O O A, Molokwu E C I, Eduvie L O and Dim N I 1992. Dietary supplementation in the Savanna Brown goat. II. Gestation and postpartum activity in primiparous does. Animal Reproduction Science 29 (1-2): 167-174.
Guignot F 2005. Cryoconservation des embryons des espèces domestiques. INRA Productions Animales 18 (1) 27-35.
http://granit.jouy.inra.fr/productions-animales/2005/Prod_Anim_2005_18_1_02.pdf
Hafez E S E 1987. Reproductive behaviour. In Reproduction in farm animals, fifth edition
(ed. E S E Hafez), pp. 260-294. Lea and Febiger, Philadelphia.
Henniawati and Fletcher I C 1986. Reproduction in Indonesian sheep and goats at two levels of nutrition. Animal Reproduction Science (12) 77-84.
Hervieux J et Morand-Fehr P 1999. Comment noter l’état corporel des chèvres. Réussir La Chèvre – Mars-Avril 1999 – N° 231. p 26-33.
Jarrel V L et Dziuk P J 1991. Effect of number of corpora lutea and foetuses on concentrations of progesterone in blood of goats. Journal of Animal Science 69: 770-773.
Kalkan C, Cetin H, Kaygusuzoglu E, Yilmaz B, Ciftci M, Yldiz H, Yildiz A, Deveci H, Apaydin A M and Ocal H 1996. An investigation on plasma progesterone levels during pregnancy and at parturition in Ivessi [Awassi] sheep. Acta Veterinaria Hungarica 44: 335-340.
Khanum S A, Mujahid H and Rehana K 2007. Assessment of reproductive parameters in female Dwarf goat (Capra hircus) on the basis of progesterone profiles. Animal Reproduction Science 102 (3/4): 267-275.
Khanum S A, Hussain M and Kausar R 2008. Progesterone and estradiol profiles during estrous cycle and gestation in Dwarf goats (Capra hircus). Pakistan Veterinary Journal 28:1-4.
Kolb E 1975. Physiologie des animaux domestiques. Paris, Vigot Frères ed, 1 vol, 974 p.
Lajous D 1987. Mesure du taux d’ovulation et de la mortalité embryonnaire chez la brebis Romanov. Utilisation et intérêt de la coelioscopie. Thèse de doctorat, Institut national polytechnique, Toulouse, France, 71 p.
Linzell J L and Heap R B 1968. A comparison of progesterone metabolism in the pregnant sheep and goat: sources of production and an estimation of uptake by some target organs. Journal of Endocrinology 41: 433-NP.
Luna-Orozco J R, Fernandez IG, Gelez H and Delgadillo J A 2008. Parity of female goats does not influence their estrous and ovulatory responses to the male effect. Animal Reproduction Science, 106 (3-4) : 352-360.
Manjeli J, Teguia A, Njwe R M, Tchoumboue J et Ayong E E 1994. Enquête sur l'élevage caprin dans les Hauts-Plateaux de I'Ouest Cameroun. ln: Small Ruminant Research and Development ILRI, pp 99-103.
Mbayahaca J, Baudoux C, Mandiki S N M, Bister J L, Branckaert R et Paquay R 1997. Paramètres de reproduction et de production des petits ruminants au Burundi. Animal Genetic Resources Information 20: 55-69.
Meyer C et Djoko Teinkam D 2010. L’effet mâle chez les petits ruminants : Synthèse. Livestock Research for Rural Development 22 (09).
http://www.lrrd.org/public-lrrd/proofs/lrrd2209/meye22173.htm
Odubote I K 1994. Genetic analysis of the reproductive performance of West African Dwarf goats in the humid tropics (pp 33-35). In Small Ruminant Research and Development in Africa (Lebbie S H B and Kagwini E eds). Proceedings of the Third Biannual Conference of the African Small Ruminants Research Network, UICC, Kampala, Uganda, 5-9 December.
Ozpnar A, Ozpnar H, Frat A, Pabuccuoglu S, Alkan S and Ledl W 1992. Investigations on the relationship between the blood progesterone profile and lambing rate in Turkgeldi sheep under different conditions of management and nutrition. Hayvanclk Arastrma Dergisi 2: 35-38.
Paterson L, De Sousa P, Ritchie W,
King T and Wilmut I 2003. Application of reproductive
biotechnology in animals: implications and potentials applications of
reproductive cloning. Animal Reproduction Science 79:137–143.
Ranilla M J, Sulon J, Mantecon A R, Beckers J F and Carro M D 1997. Plasma pregnancy-associated glycoprotein and progesterone concentrations in pregnant Assaf ewes carrying single and twin lambs. Small Ruminant Research 24: 125-131.
Rawlings N C, Jeffcoate I S, Savage D M K and Steuart L H M 1983. Pregnancy diagnosis and assessment of fetal numbers in the ewe in a commercial setting. Theriogenology 19: 655-663.
Robertson H A 1977.
Reproduction in the ewe and the goat : 477-496. In “Reproduction in domestic
animals”(Cole H H and Cupps P T, eds) 3rd ed. Academic Press,
New York, 665 p.
Sawada T, Nakatani T, Tamarda H and Mori J 1994. Secretion of progesterone and 20alpha-dihydroprogesterone during pregnancy in goats. Steroids 59 (august): 468-471.
Sheldrick E L, Ricketts A P and Flint A P F 1981. Placental production of 5beta pragnane-3alpha,20alpha-diol in goats. Journal of Endocrinology 90: 151-158.
Thimonier J 1975. Etude de la puberté et de la saison sexuelle chez les races prolifiques et leurs croisements avec des races françaises. In : lères Journées de la recherche ovine et caprine, Paris, France, 2-4 décembre 1993. Paris, France, INRA-ITOVIC, p18-37.
Thorburn G D et Schneider W 1972. The progesterone concentration in the plasma of the goat during the oestrous cycle and pregnancy. Journal of Endocrinology 52, 23-28.
Waldron D F, Thomas D L 1992. Increased litter size in Rambouillet sheep: 1. Estimation of genetic parameter. Animal Science 70: 3333-3344.
Wango E O, Heap R B and Wooding F B P 1991. Progesterone and 5beta-pregnanediol production by isolated fetal placental binucleate cells from sheep and goats. Journal of Endocrinology 129: 283-289.
Yigit A 2003. Changes in the size distribution of goat steroidogenic luteal cells during pregnancy. Small Ruminants Research 47: 227-231.
Received 10 October 2010; Accepted 23 February 2011; Published 1 April 2011